澳洲TGA认证
┃澳洲TGA认证
根据澳大利亚医疗用品法(therapeutic goods act 1989)规定,所有在澳大利亚上市的医疗用品(药品和医疗器械)必须向澳大利亚医疗用品管理局(TGA)提出注册或登记申请,获得注册登记(Australian register of therapeutic goods, ARTG)后才能合法上市。

┃审核机构
►TUV南德
►Intertek天祥
►SGS通标
►CTI华测
┃客户群体
1.医疗器械制造商/出口商
所有医疗器械(从低风险到高风险)均需TGA注册,包括:
●Class I(如医用口罩、纱布、轮椅)
●Class IIa/IIb(如血糖仪、输液泵、隐形眼镜)
●Class III(如心脏支架、人工关节、植入式除颤器)
●Active Implantable Medical Devices (AIMD)(如心脏起搏器)
●体外诊断设备(IVD)(如COVID-19检测试剂、HIV试剂)
2.药品(处方药、OTC、草药、生物制品)
●处方药(Prescription Medicines)
●非处方药(OTC,如感冒药、维生素)
●传统草药(Traditional Medicines)
●生物制品(Biologics,如疫苗、单抗)
3.血液及血液制品
●全血、血浆、血小板等血液成分
●血液衍生物(如凝血因子、免疫球蛋白)
4.化妆品(含治疗性功效的)
●普通化妆品 不需要TGA认证
●但如果产品宣称 治疗功效(如祛痘、防晒、抗皱),则可能被归类为“治疗性产品”并需要TGA注册。
例如:含 防晒(SPF) 的护肤品、含 水杨酸 的祛痘产品
5.消毒剂和抗菌产品
●如果产品宣称 医疗级消毒(如医院用消毒液、外科手消毒剂),则需要TGA注册。
●普通家用消毒剂(如滴露)通常不需要。
┃TGA注册流程
1. 澳代在TGA eBS数据库中申请新建制造商信息(制造商名称、地址、制造商ID)。
2. 澳代在TGA提交制造商证据(Manufacturer evidence)
3. 澳代与制造商按照Therapeutic Goods (Medical Devices) Regulations 2002确定正确的适用风险分类
4. 澳代与制造商查询GMDN数据库,选择适用的GMDN code & term
5. 制造商提供详细技术文件,证明产品符合安全和性能基本原则(Essential Principles)
6.制造商准备澳大利亚符合性声明
7.澳代在TGA eBS系统中创建申请,填写信息,上传说明书、标签、符合性声明等文件,完成申请递交并支付申请费。
8. 一些中风险的器械产品可能会被抽中进行产品审核,此类审核免收审核费。一些中高风险器械和IVD产品会被强制进行产品审核,澳代需要支付审核费。澳代收到TGA发送的补充信息通知后,通知并协助制造商在四周时间内对存在问题进行解释或更正,补充相关材料或做出撤回申请的决定。
9. 澳代获得TGA审核通知。如申请成功,产品将包含在ARTG数据库中,供公众查询。澳代可在TGA eBS系统中下载完整的ARTG证书。
10. 产品上市后监管下图为启动TGA注册的常见前置条件。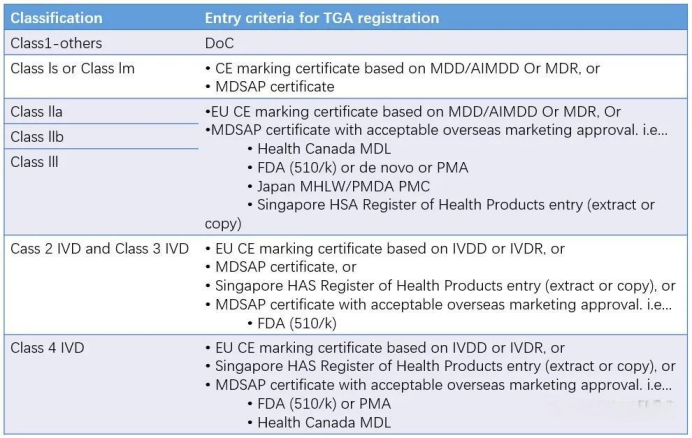
┃澳洲TGA认证的审核内容
一、审核内容
澳大利亚是迄今为止世界上公认的药品生产标准最严格、法规最完备、执行最严厉的国家之一,在国际上被誉为药品安全管理的典范。
TGA对药品的监管注重在以下三个方面:
1.药物上市前的评估。所有药品、医疗器械在进入澳市场前,均要在TGA登记注册,对其风险进行评估。
2.药品生产厂的许可认证。澳大利亚的药品制造商必须经过TGA许可,并通过药品生产质量管理规范(GMP)认证。
3.市场的后期监管。TGA有权对市场上的药品进行抽样化验检查,以确保其符合质量、安全标准。
比如对于原材料来说,TGA有相当严格的规定:
1.必须是已经有足够人类临床证据,证明其安全性和相关功效,任何有风险的原料都不会被允许使用;
2.这些原料的使用方式、剂量等都有严格的标准;
3.在生产完成以后,产品还必须交由TGA认证的实验室进行质量检测和稳定性测试。
但实际上TGA除了管理药品,还负责医疗器械、疫苗、血液、血液制品等等和医疗相关的产品。
二、关于澳大利亚TGA 证书
任何在澳大利亚售卖的医疗用品必须经过TGA审核,审批通过的产品将列入ARTG名单,即获得ARTG证书。
Q&A
问:ARTG证书有编号吗?
ARTG Identifier是属于证书的独特编号。
问:ARTG证书有效期是多久?
ARTG证书有效期为⼀年,以后每年付年费后证书可以持续有效。
问:ARTG证书上没有我的产品名字,能加上去吗?
ARTG证书是以医疗器械归类的,按照GMDN Code和Term命名,不突出制造商的产品名。
问:ARTG证书有编号吗?
ARTG Identifier是属于证书的独特编号。
三、澳洲TGA认证分类
澳大利亚TGA根据医疗器械风险等级从低到高,将医疗器械分为Ⅰ类、Ⅱa类、Ⅱb类、Ⅲ类,AIMD,体外诊断试剂IVD则分为1、2、3、4类。
┃联系我们
┃QAWORKS平台的优势
★QAWORKS承诺公平公正公开,拥有权威的审核机制,专业筛选认证服务商,资质真实可靠。
★QAWORKS拥有丰富资源,网络覆盖多个行业领域,平台旗下有60+资深顾问,500+机构及千名专家。
★QAWORKS下合作机构驻扎全国各地,辐射全国超5000家制造企业。
★QAWORKS专业团队为企业优选高性价比机构,解决质量、认证、知识产权等全链问题。
★QAWORKS实时观测行业动态,及时发布专业的行业消息,助力为企业了解行业更加便利。
★QAWORKS为用户提供公开投标服务,透明化市场价格,助力行业良性循环。
好评率:100%
好评数量: 0 个
工作速度:0分
工作质量:0分
工作态度:0分
分享至
其他服务推荐 更多>

BRC认证
体系认证
¥99起
BSCI商业社会标准认证
体系认证
¥16318起
SCAN反恐验厂
体系认证
¥99起
欧盟有机认证
产品认证
¥99起
ASC水产养殖认证
体系认证
¥99起
NON-GMO非转基因认证
产品认证
¥99起
ECOCERT认证
产品认证
¥99起
Sedex-SMETA审核
体系认证
¥12281起
USDA美国有机认证
产品认证
¥99起
日本JAS食品认证
产品认证
¥99起
HALAL食品清真认证
产品认证
¥99起
kosher犹太食品认证
产品认证
¥99起
MSC认证
产品认证
¥99起
COSMEBIO认证
产品认证
¥99起
SQF安全优质食品
体系认证
¥99起
HACCP危害分析与关键控制点
体系认证
¥99起
SA8000验厂
产品认证
¥99起